Groupe de consultations en R.-D. de Syneos Health. État de préparation pour répondre à la Réglementation sur les essais cliniques de l’Union européenne.
Prêt(e) à répondre à la Réglementation sur les essais cliniques de l’Union européenne?
La réglementation sur les essais cliniques de l’Union européenne (EU CTR) devrait changer radicalement le paysage des essais cliniques en Europe. Le nouveau système d’information sur les essais cliniques (CTIS) a été officiellement mis en service le 31 janvier 2022, marquant le début d’une période de transition de trois ans au cours de laquelle les entreprises doivent mettre en œuvre des processus actualisés et évaluer les systèmes pour permettre la conformité et une interface efficace avec le CTIS.
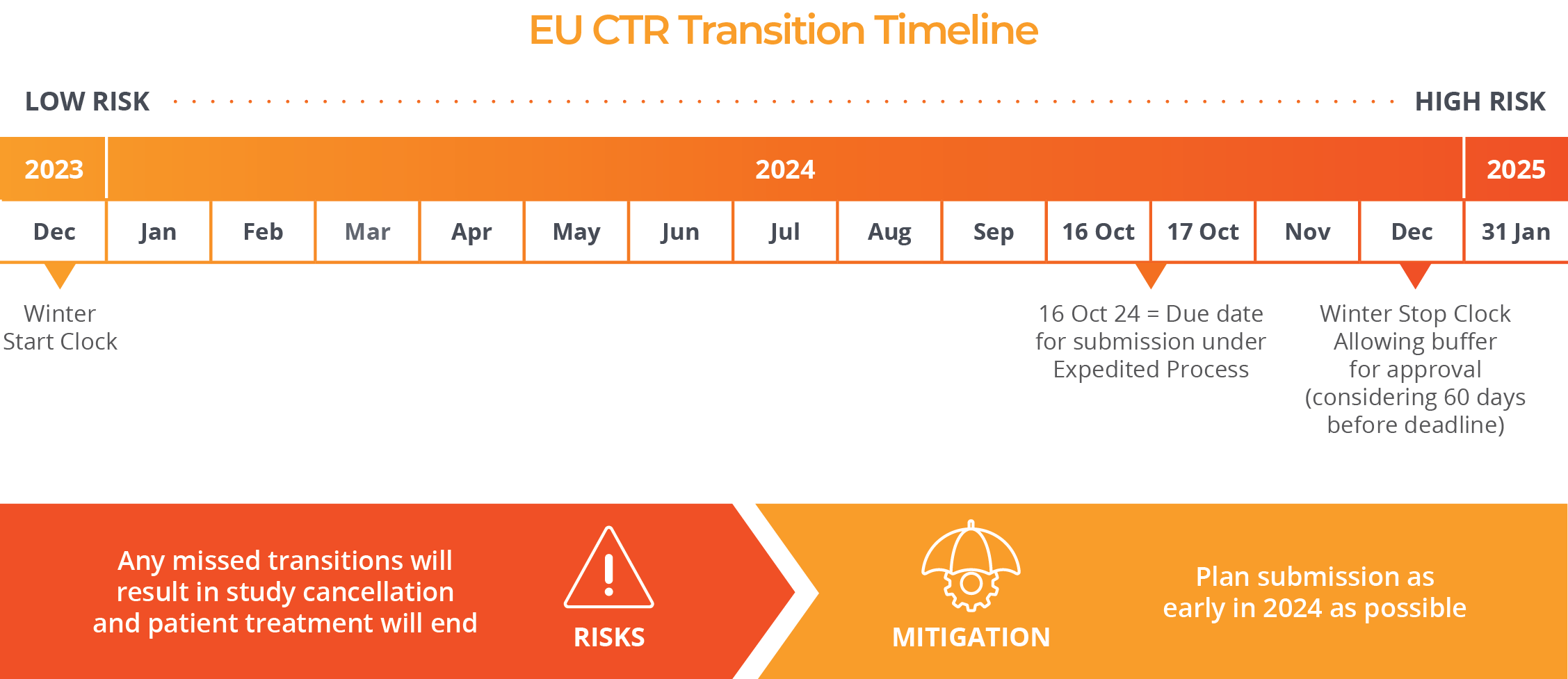
In order to transition to these new regulations, sponsors will need to submit trials before the end of the transition period on 30 January 2025. After that date, a transition will no longer be possible and a new clinical trial application under the new CTR will be required.
Until the middle of October of 2024, an administrative transition process published by the Clinical Trials Coordination Group (CTCG) is available with minimum requirements and short deadlines.
Remember, if your trial is running in EU/EEA and has at least one active site* beyond 31 January 2025, it is MANDATORY to switch the trial to the new EU regulation.
*Active site means that if the last visit last subject (LVLS) or any other trial specific intervention with the subject as specified in the protocol took place before this date, the trial does not need to be transitioned.
If there are no active sites in EU/EEA but the End of Trial has not yet been notified, the trial should not be transitioned.
Start immediately to prepare your transition.
La Réglementation européenne sur les essais cliniques a pour objectif de créer un environnement favorable à la conduite d’essais cliniques dans l’Union européenne, avec les normes de sécurité les plus élevées pour les participants et une plus grande transparence en ce qui concerne les renseignements sur les essais. Pour atteindre cet objectif, la réglementation a introduit de nouvelles exigences dont les promoteurs doivent être conscients afin d’être prêts à mettre en œuvre les changements imposés par la réglementation.

The transition application is a complex procedure and includes submission using the CTR-CTIS portal of the most recently approved CTD documentation in all member states concerned. The aim of this application is for you to continue to run your clinical trial beyond 30 January 2025 without discontinuation.
Syneos Health is uniquely positioned to expedite your CTR transition journey. We have a strong, established EU regulatory framework. We also have a proven track record demonstrating our knowledge, actionable insights and quality in multiple therapeutic areas, types of products, countries and trial design applications.

The Syneos Health integrated EU CTR offering can provide end-to-end support to sponsors irrespective of their readiness. We can support in preparing you to be ready to conduct trials under EU CTR and your ongoing delivery of clinical trials under the EU CTR. We are already supporting our customers with this.


